A solvatação, habitualmente chamada dissolução, é um processo de atracção e associação de moléculas de um solvente com as moléculas ou os iões de um soluto. À medida que o soluto se dissolve, as moléculas ou iões dispersam-se e ficam rodeadas por moléculas do solvente. [1]
Darei como exemplo o que sucede com o sal que nos é mais comum - o cloreto de sódio, vulgarmente chamado sal de cozinha.
Na imagem da direita podemos observar o modo como os catiões sódio (Na+) - iões positivos - e os aniões cloreto (Cℓ-) - iões negativos - se organizam de modo a formarem o cristal de cloreto de sódio (NaCℓ). Mais informação aqui.
Os que estão dentro do assunto, facilmente identificam o catião como o azul (o menor) e o anião como o laranja (o maior). Porquê?
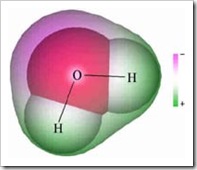
A molécula de água é um exemplo de um solvente polar, devido à assimetria na sua nuvem electrónica, havendo uma parte da molécula de água com maior densidade electrónica, sendo ligeiramente negativa, e outra parte em que a densidade electrónica é menor, sendo ligeiramente positiva. Isto é possível observar na imagem à direita (encontrada aqui).
Este dipolo eléctrico é representado pelos símbolos δ+ (delta mais) e δ- (delta menos). Como o oxigénio é mais electronegativo que o hidrogénio, é lá que se encontra o δ-.
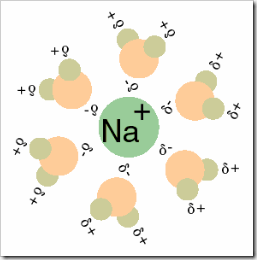
Nas imagens abaixo está representada a interacção das moléculas de água com os iões do sal. Repare na forma como se estabelecem interacções entre as moléculas de água quer com os catiões, quer com os aniões.
As interacções dipolo - ião que se estabelecem implicam a quebra das interacções ião - ião da rede iónica e também influenciam as interacções dipolo - dipolo existentes entre as moléculas de água.
Quando os iões estão cercados por moléculas de água, diz-se que estão solvatados.
De um modo simples, podemos afirmar que quando já não há moléculas de solvente para rodear os iões (ou outras moléculas) diz-se que a solução se encontra saturada, pois não se consegue dissolver mais soluto. À quantidade máxima de soluto que foi possível dissolver numa dada quantidade de solvente (a uma dada temperatura) dá-se, habitualmente, o nome de solubilidade. Para o cloreto de sódio conseguem dissolver-se cerca de 36 gramas em 100 ml de água.
O seguinte vídeo mostra-nos a dissolução do cloreto de sódio. Encontrado aqui - Dissolução de um sal em água. Mais uma vez, aqui fica o meu agradecimento ao Carlos Portela.
















6 comentários:
hoje já consegui ver o vídeo ...
ele é bom para perceber o que está nas páginas 226 e 228
Ainda bem que já conseguiste.
Diz-me se continuas a ter problemas com o IE sff.
nao cosigo entender as ligaçoes ionicas, gostava que o professor me esclarecesse, ja vi no livro e nos apontamentos, e aqui no blog nao encontro.
:) by: tatiana 9C
hoje tentei ver este vídeo no IE 7
não dá nada ...
eu carrego no play e depois não aprece nada ...
Carolina, eu consigo ver perfeitamente em qualquer browser. Actualiza o flash e depois tenta novamente. Tens o link na lateral do blogue. IE sucks!
Tatiana, falamos amanhã na aula. Também podes aparecer, para variar, na aula de recuperação.
eu consigo ver bem os vídeos quando utlizo o Mozilla ...
só não consigo com o IE, mas não interessa desde que os consiga ver!
Enviar um comentário
1) Identifique-se.
2) Seja respeitoso e cordial.
3) São bem-vindas críticas construtivas e correcções.
4) Leia primeiro os comentários anteriores.