Átomos do mesmo elemento químico podem ter um número diferente de neutrões. As diferentes versões possíveis para cada elemento são chamadas
isótopos. Conhecem-se 80 elementos com pelo menos um isótopo estável. O estanho, Sn, é o elemento com mais isótopos estáveis, 10.
Quantos isótopos pode um elemento ter? Será que cada átomo pode ter um num qualquer de neutrões?Não! Há combinações de protões e neutrões que são estáveis. Elementos mais leves tendem a ter igual número de protões e neutrões, mas os elementos pesados precisam, aparentemente, de mais neutrões do que protões para que o seu núcleo seja estável. Quando esta estabilidade não é conseguida, os isótopos podem existir por algum tempo, mas são instáveis.
O que significa ser instável? Os átomos partem-se quando não têm o número certo de neutrões? De certo modo, sim. Os átomos instáveis são radioactivos: o seu núcleo decai, emitindo radiação sob a forma de partículas ou ondas electromagnéticas.
Para exemplificar esse decaimento, indico mais adiante uma aplicação Java que mostra uma tabela com alguns isótopos e a forma como decaem.
Há várias formas de um átomo radioactivo decair. Por exemplo, o trítio ou hidrogénio-3, tem demasiados neutrões para ser estável.
 O que acontece então? Expulsa um neutrão?
O que acontece então? Expulsa um neutrão?Não, os neutrões estão fortemente “fixados” no núcleo. O que acontece pode ser visto na aplicação Java (
clique na imagem). Clique no trítio. O que observa? Pois é, um neutrão transformou-se num protão! Conseguiu-se, desta forma, que um isótopo instável do hidrogénio se convertesse num isótopo estável de hélio, o
hélio-3.
Explore a aplicação, vai reparar que muitos isótopos são estáveis, enquanto que outros têm vidas mais ou menos longas, convertendo-se noutros elementos.Mas assim não se perdeu massa? Não! Analisemos em maior pormenor o que aconteceu. Se reparar, o
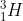
e o
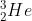
têm o mesmo número de massa, o que é bom, pois a massa tem que ser conservada. Há, no entanto, um problema: A carga eléctrica tem que ser conservada e isso, à primeira vista, parece que não sucedeu. O hidrogénio tem apenas um protão e o hélio tem dois, portanto
parece que se criou carga positiva.
 Como explicar isto?
Como explicar isto?Quando ocorre a transformação, também é libertado um electrão, que tem uma massa muito reduzida e que tem carga negativa, que cancela a do protão. Este processo tem o nome de
decaimento beta e, neste contexto, o electrão é conhecido por partícula beta. Também é libertado um antineutrino, mas agora não iremos falar dele.
Pode-se escrever uma equação que descreva esta reacção?Sim! Tal como se escrevem equações químicas, entre substâncias diferentes, com reagentes e produtos de reacção, também se pode escrever a equação nuclear que descreve este processo.
Podemos escrever a equação do decaimento beta do trítio, dando ao electrão um número de massa 0 (já que é cerca de 2000 vezes mais leve que o protão ou neutrão) e um número atómico de -1 (por causa da sua carga, claro).
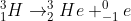
Este processo liberta ainda um antineutrino e 18,6
keV de energia.
Repare que os números de massa de cada lado dão o mesmo total (3 = 3 + 0), acontecendo o mesmo com as cargas (1 = 2 + -1). Isto tem que ser sempre verdade numa reacção nuclear.
Existem outras formas de decaimento, mas fica para um próximo artigo.
Fontes: [
1], [
2], [
3]